美国紧急使用授权(EUA)政策适用范围和申请方式
文章来源:华道顾问 录入:华道顾问 添加时间:2020/4/27
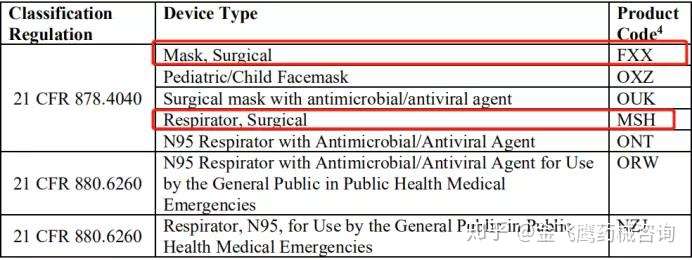
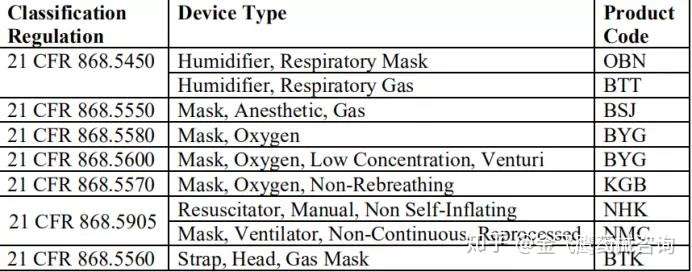
接着FDA说明以下产品代码不在该政策适用范围,有且不限于以下这些:
如何申请EUA
未在美国境内的上市的医疗用途的外科口罩、N95口罩,不管是美国境内还是境外制造商,都可以申请紧急授权。需要递交以下资料,并发送到FDA 这个邮箱:CDRH-COVID19-SurgicalMasks@fda.hhs.gov,由FDA审核是否可以授予紧急授权,让该产品在新冠疫情期间在美国境内销售。
以上递交资料适用于本来就已经生产医疗器械、但口罩尚未在美国境内上市的制造商。有两点是需要注意的:
1、FDA只是减免了510(k)技术文档要求,但关于产品测试,生产车间质量体系的要求是从未有放弃的;
2、在新冠肺炎疫情爆发期间内,FDA不拘泥于任何区域的产品标准,只要你是做相关产品测试,欧盟的、中国的,都可以将测试报告递交,由FDA决定是否可以授予紧急授权。
此外,FDA也欢迎非医疗器械企业生产销售医疗器械,可以粗暴理解成就是连生产车间QSR820都未外审过的制造商,至于要怎么操作,发邮件问FDA。
1、FDA只是减免了510(k)技术文档要求,但关于产品测试,生产车间质量体系的要求是从未有放弃的;
2、在新冠肺炎疫情爆发期间内,FDA不拘泥于任何区域的产品标准,只要你是做相关产品测试,欧盟的、中国的,都可以将测试报告递交,由FDA决定是否可以授予紧急授权。
此外,FDA也欢迎非医疗器械企业生产销售医疗器械,可以粗暴理解成就是连生产车间QSR820都未外审过的制造商,至于要怎么操作,发邮件问FDA。

 当前位置:
当前位置: